Questo studio è finalizzato a determinare le condizioni operative ottimali per la degradazione termica senza fiamma di PFAS (Poly-and Per-FluoroAlkyl Substances) in una soluzione concentrata ottenuta a partire da un percolato di discarica, localizzato in provincia di Vicenza
E' stato inizialmente effettuato uno studio della letteratura scientifica per valutare quali trattamenti fossero indicati per il trattamento di matrici liquide contaminate da PFAS; successivamente, al fine di valutare l'efficacia del trattamento termico senza fiamma, sono stati condotti test preliminari su soluzioni sintetiche di PFBA (acido perfluorobutanoico) disciolto in acqua; infine, sono stati svolti test sistematici su percolato di discarica concentrato, al fine di massimizzare la conversione delle sostanze fluorurate in HF (acido fluoridrico). Il setup utilizzato è composto da un reattore a doppio stadio, nel quale vi è una prima fase di vaporizzazione della soluzione e una successiva fase di trattamento dei vapori ad alta temperatura, durante la quale avviene la degradazione delle sostanze fluorurate.
Per quantificare l'efficacia del trattamento, viene valutata la quantità di HF prodotto, condensandolo in una trappola basica. Lo studio dimostra che il trattamento puramente termico è efficace, ottenendo ottimi valori di degradazione dei PFAS (circa 100%) e di conversione di questi in HF (>80%), con una temperatura operativa di 950°C e con un tempo di residenza di circa 20 minuti.
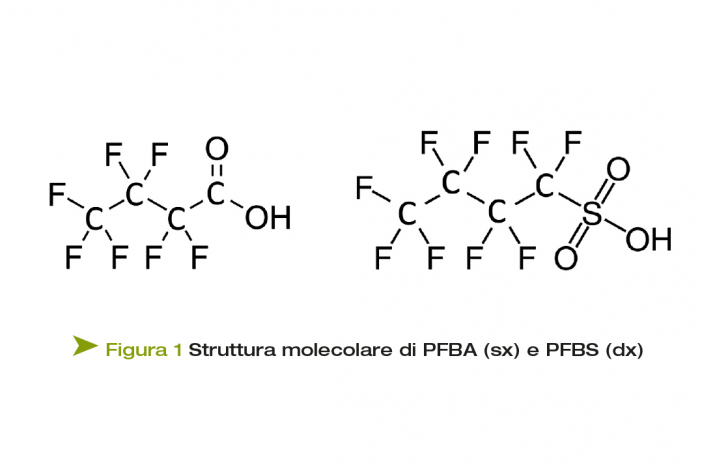
I PFAS (Poly - and Per-FluoroAlkyl Substances) sono una classe di composti chimici sintetici che appartiene alla categoria degli Emerging Contaminants (ECs). Risultano costituiti da una molecola di lunghezza variabile, contenente un gruppo perfluoroalchilico con tre o più atomi di carbonio (vale a dire - CnF2n -, n ≥ 3) o un gruppo perfluoroalchiletere con due o più atomi di carbonio (vale a dire - CnF2nOCmF2m -, n e m ≥ 1).
Possono presentare un gruppo funzionale carbossilico oppure solfonico: se ne riportano due esempi in Figura 1.
I PFAS possono trovarsi allo stato liquido o solido, in funzione della lunghezza della loro catena. Maggiore è il numero di atomi di C presenti nella catena, più elevate saranno le proprietà fisiche dei PFAS, come la massa molare, il volume molare, l'area superficiale totale ed il punto di fusione; queste sostanze sono più pesanti dell'acqua e sono miscibili con la maggior parte dei solventi organici.
I PFAS comprendono un ampio gruppo di oltre 5000 sostanze artificiali e sono utilizzati in una vasta gamma di applicazioni industriali, grazie alle loro proprietà impermeabilizzanti verso acqua ed oli e alla loro capacità di resistere a condizioni ambientali estreme. Nonostante i PFAS abbiano proprietà idrofobe, in base alle quali vengono impiegati per le loro caratteristiche idrorepellenti, i loro gruppi funzionali (carbossilico e solfonico) li rendono idrofili e, come tali, solubili in acqua.
Sono stati condotti studi [1] che indicano che i PFAS a catena lunga hanno un potenziale maggiore di bioconcentrazione nei livelli trofici, rispetto ai PFAS a catena più corta. D'altra parte, la maggiore solubilità in acqua e la ridotta capacità di bioaccumulo dei PFAS a catena corta, li rende più mobili nelle falde acquifere, arrivando fino a contaminare la porzione commestibile di alcune colture.
La scarsa efficacia dei tradizionali metodi di trattamento (biologici e chimico-fisici) dei PFAS è dovuta alla forza del legame C-F, causata dall'elevata elettronegatività del fluoro (3.98).
Sono stati dunque investigati potenziali processi e relative condizioni operative, che possano portare alla stabilizzazione dei PFAS contenuti in matrici liquide.
Le tecnologie di trattamento si classificano in: trattamenti biologici, nei quali viene sfruttata l'azione di funghi e batteri [2], ma che richiedono tempi di trattamento molto lunghi e non sono efficaci nella totale degradazione dei PFAS, perciò non sono praticabili a livello industriale; metodi meccanici, come il ball milling [3], sui quali attualmente non sono noti esperimenti che non siano su scala di laboratorio; metodi chimico-fisici, tra cui tecniche come l'ossidazione elettrochimica [4], la sonolisi [5], la fotolisi [6], l'ozonazione [7] e il trattamento al plasma [8]. Tra le tecnologie che sfruttano l'azione chimico-fisica, i metodi di ossidazione elettrochimica [4] sono quelli con un miglior rapporto costo/efficienza di trattamento; tuttavia, gli studi in cui viene utilizzata questa tecnologia sono condotti su campioni molto diluiti, con una quantità di acqua >95% e non è mai stata investigata la quantità minima di acqua per la quale
il trattamento rimane efficace [9]; infine i trattamenti termici, tra cui l'incenerimento, la liquefazione idrotermale e lo smouldering: con queste tecnologie, i prodotti chimici vengono distrutti sfruttando l'energia termica. La tecnologia di degradazione termica dei PFAS più conosciuta e utilizzata su scala industriale è l'incenerimento, che consiste in un processo ad alta intensità energetica, finalizzato alla completa mineralizzazione della molecola, con mezzi termici [10].
In questo studio viene approfondita la degradazione delle molecole fluorurate mediante un processo puramente termico senza fiamma.
Sperimentazioni e risultati
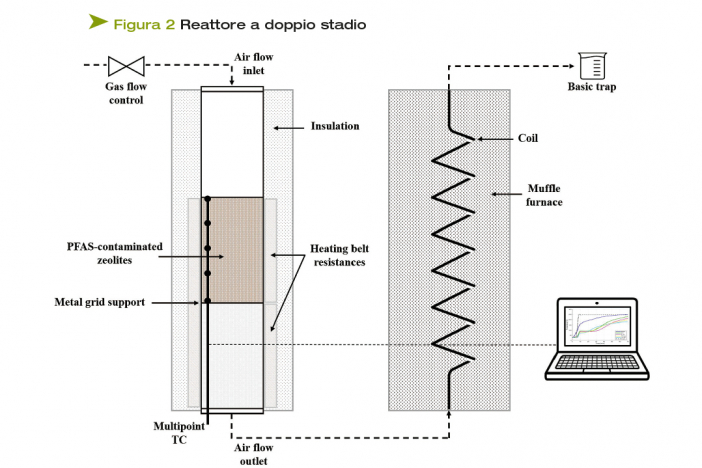
Il setup impiegato in questo studio è composto da un trattamento termico a doppio stadio (Figura 2): una prima fase di vaporizzazione della soluzione contaminata, durante la quale i PFAS vengono vaporizzati, è seguita da una fase successiva di trattamento dei vapori ad alte temperature, durante la quale avviene la degradazione delle sostanze fluorurate. Al fine di valutare l'efficacia del trattamento, a valle del setup è posta una trappola sodica 1.25M, per raccogliere l'acido fluoridrico prodotto e le sostanze fluorurate non reagite. Il I stadio del setup è composto da un reattore tubolare di diametro interno di 4 cm, all'interno del quale un flusso di aria modulabile passa attraverso un letto di zeoliti, utilizzato come supporto poroso, alto circa 10 cm, che viene bagnato con le soluzioni contaminate. Il reattore viene riscaldato esternamente tramite delle resistenze a fascia. Le temperature all'interno del reattore vengono monitorate mediante una termocoppia multipoint posizionata all'interno del letto di zeoliti.
Il flusso d'aria in uscita dal reattore, che trascina i vapori di PFAS generati, passa attraverso una linea riscaldata fino all'ingresso al II stadio, costituito da una spirale in acciaio, posizionata all'interno di una muffola in grado di raggiungere i 1100°C.
Sono stati inizialmente condotti test preliminari su soluzioni sintetiche di PFBA (Tabella 1), mantenendo costante la temperatura al I stadio e sulla linea di collegamento (250°C), e variando la temperatura al II stadio (700÷950°C) e la portata d'aria di carrier (5÷300 mL/min), in modo tale da variare i tempi di residenza nel II stadio (0.3÷23 min circa).
Poiché è nota la quantità di contaminante fluorurato caricato, è possibile ricavare la conversione percentuale in HF, rispetto alla quantità massima ottenibile.
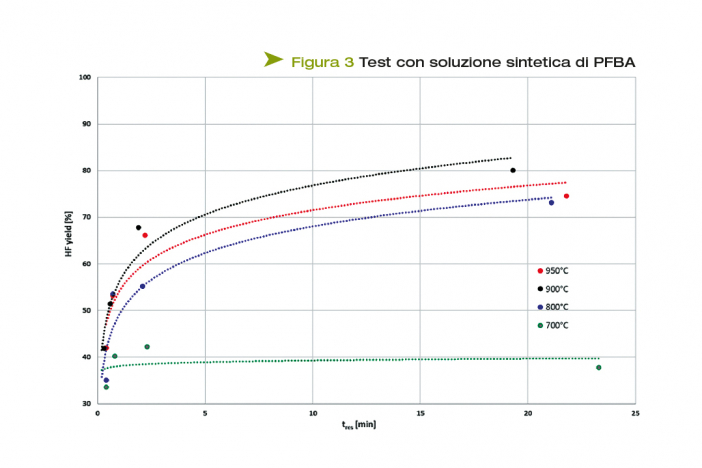
La Figura 3 mostra le percentuali di HF ottenute, al variare del tempo di residenza nel II stadio, mediante curve parametriche nella temperatura qui impostata.
I profili in Figura 3 mostrano un trend crescente nelle rese di mineralizzazione di PFBA in HF da 700 a 900°C, poiché il processo di defluorizzazione è endotermico e perciò è favorito da un aumento di T. Mantenendo costante la temperatura al II stadio, la percentuale di HF prodotto aumenta all'aumentare del tempo di residenza del PFBA nel reattore, poiché la molecola ha più tempo per degradare, producendo una maggior quantità di HF.
Questa tendenza crescente non viene però confermata a 950°C: a questa temperatura, infatti, vengono ottenute approssimativamente le stesse rese di mineralizzazione dei test a 900°C, dimostrando che per puro effetto termico, senza fiamma e senza radicali, la massima conversione ottenibile di PFBA in HF è di circa l'80%.
Poiché le conversioni in HF ottenute in questi test non raggiungono mai il 100%, ci si potrebbe attendere di trovare la restante quantità di PFBA non reagito condensato nella trappola basica: qui, invece, si trova un residuo trascurabile di PFBA (rilevabile dallo strumento analitico, ma dell'ordine dello 0.0001% rispetto al PFBA alimentato).
Ciò dimostra che la maggior parte delle molecole di PFBA che non mineralizzano completamente ad HF, subisce una degradazione parziale, creando molecole a catena più corta (come ad esempio: CF4 e C2F6 [11]), che non sono però rilevabili dalle analisi in trappola basica.
Successivamente, si sono condotti i test su un campione di percolato di discarica concentrato (Figura 4).
La quantificazione del fluoro alimentato con il percolato è fondamentale per poter chiudere il bilancio di massa e comprendere l'effettiva mineralizzazione dei PFAS in HF.
In Tabella 2 sono messi a confronto i risultati ottenuti da analisi tradizionali (I colonna), in cui il fluoro inorganico (FI) è calcolato mediante cromatografia ionica ed il fluoro organico (FO) è calcolato come somma del fluoro contenuto nelle molecole dei 14 PFAS che la normativa richiede di monitorare (PFBA, PFBS, PFDA, PFDoA, PFHpA, PFHpS, PFHxS, PFHxA, PFNA, PFOA, PFOS, PFPeA, PFPA, PFUnA), mediante analisi SPE/UHPLC-ESI-MS/MS. In questo caso, il fluoro totale (FT) è dato dalla somma di FI e di FO.
Nella II colonna, invece, la misura del FT deriva dall'applicazione della tecnica CIC (Combustion Ion Chromatography) [12], in cui l'analisi è ancora basata su una cromatografia ionica, ma viene preceduta da un trattamento sul campione condotto in condizioni estreme, all'interno di una bomba calorimetrica (bomba di Mahler) (Method 5050 [13]): tutte le molecole contenenti fluoro (organiche e inorganiche) vengono mineralizzate ad alte temperature (attorno ai 1000°C), in atmosfera di ossigeno puro e a 31 Bar, creando ioni liberi di fluoro. Il FI è misurato, come nel caso precedente, con una cromatografia ionica su campione tal quale, mentre il FO è calcolato per differenza. La Tabella 2 rivela come le tecniche analitiche tradizionali comportino una significativa sottostima del FO e di conseguenza del fluoro totale, in quanto viene ricercato un numero estremamente limitato di composti e non si quantificano molti altri composti fluorurati sicuramente presenti, quali precursori di PFAS, fluorotelomeri e PFAS polimerici.
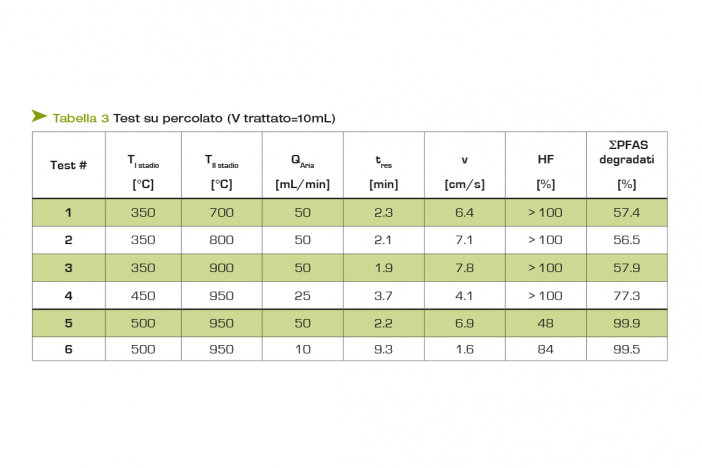
La Tabella 3 mostra la lista dei test condotti su percolato, evidenziando i principali parametri operativi variati durante la sperimentazione (T al I e II stadio e portata di carrier) ed i risultati ottenuti sia in termini di mineralizzazione totale in HF (penultima colonna) che di degradazione della sommatoria dei PFAS (ultima colonna).
L'analisi del fluoro con la tecnica CIC viene introdotta a partire dal test #5: per questo motivo, nei primi quattro test (#1÷4), in cui la quantità di F alimentato viene considerata come somma del fluoro presente nelle 14 molecole di PFAS analizzate, l'HF rilevato a fine test nella trappola basica risulta sempre > 100%, ossia si ottiene più HF rispetto alla quantità massima di HF ottenibile, confermando che, se valutato in questo modo, il F in ingresso viene significativamente sottostimato.
Nei primi tre test, la percentuale dei PFAS degradati risulta mediamente pari al 57%, evidenziando come i 350°C impostati al I stadio non siano sufficienti per una completa vaporizzazione dei PFAS dalla matrice solida (zeoliti), limitando così la degradazione ai soli PFAS che raggiungono il II stadio. Aumentando la temperatura del I stadio a 450°C (test #4), i PFAS degradati raggiungono il 77%, e successivamente, portando il I stadio a 500°C, si ottengono valori prossimi alla degradazione completa dei PFAS, come mostrano gli ultimi due test in Tabella 3.
Impostando a 950°C la temperatura al II stadio, si raggiungono conversioni in HF crescenti (>80%), all'aumentare del tempo di residenza nel reattore.
Conclusioni
Lo studio ha lo scopo di verificare la possibilità di mineralizzare, per via puramente termica, i PFAS presenti in una soluzione liquida contaminata. Il setup impiegato nel corso dei test sperimentali è costituito da un reattore a doppio stadio: un I stadio di vaporizzazione delle molecole fluorurate, seguito da uno stadio di degradazione termica ad alte temperature senza fiamma.
Sono stati inizialmente condotti test sperimentali su un PFAS modello (PFBA sintetico) per identificare le condizioni operative ottimali e per massimizzare la conversione della molecola fluorurata in HF.
Successivamente, è stata condotta una serie di test sistematici su percolato di discarica concentrato, confermando la possibilità di ottenere elevate rese percentuali in HF (oltre l'80%) ed elevate rese di degradazione dei PFAS (100% ca.), mediante un trattamento puramente termico (senza fiamma).
Tuttavia, per ottenere questi risultati è necessario lavorare con tempi di residenza molto elevati (ordine dei minuti), impraticabili a livello impiantistico: per diminuire i tempi di reazione è necessario sviluppare un impianto di degradazione termica che permetta di accelerare la cinetica di degradazione e mineralizzazione dei PFAS, sfruttando l'azione radicalica della fiamma.
Bibliografia
[1] I. Ross, J. McDonough, J. Miles, P. Storch, P. T. Kochunarayanan, E. Kalve, J. Hurst, S. S. Dasgupta, J. Burdick, A review of emerging technologies for remediation of PFASs, Remediation (2018), 28, 101-126, DOI: 10.1002/rem.21553.
[2] Colosi L.M., Pinto R.A., Huang Q., Weber W.J., Peroxidase-mediated degradation of perfluorooctanoic acid. Environmental Toxicology and Chemistry, 2009, 28(2), pp. 264-271.
[3] Zhang K., Huang J., Yu G., Zhang Q., Deng S., Wang B., Destruction of Perfluorooctane Sulfonate (PFOS) and Perfluorooctanoic Acid (PFOA) by Ball Milling. Environmental Science & Technology, 2013, 47 (12), pp. 6471-6477.
[4] Trautmann A., Schell H., Schmidt K., Mangold K., Tiehm A. (2015). Electrochemical degradation of perfluoroalkyl and polyfluoroalkyl substances (PFASs) in groundwater. Water Science and Technology, 71, pp. 1569-1575.
[5] Cheng J., Vecitis C.D., Park H., Mader B.T., Hoffmann M.R. (2010), Sonochemical Degradation of Perfluorooctane Sulfonate (PFOS) and Perfluorooctanoate (PFOA) in Groundwater: Kinetic Effects of Matrix Inorganics, Environmental Science & Technology, 44, pp. 445-450.
[6] Giri R.R., Ozaki H., Morigaki T., Taniguchi S., Takanami R. (2011), UV photolysis of perfluorooctanoic acid (PFOA) in dilute aqueous solution, Water Science & Technology, 63(2), pp. 276-282.
[7] Lin A.Y.C., Panchangam S.C., Chang C.Y., Hong P.K.A., Hsueh H.F. (2012), Removal of perfluorooctanoic acid and perfluorooctane sulfonate via ozonation under alkaline condition, Journal of Hazardous Materials, 243, pp. 272-277.
[8] Yasuoka K., Sasaki K., Hayashi R. (2011), An energy-efficient process for decomposing perfluorooctanoic and perfluorooctane sulfonic acids using dc plasmas generated within gas bubbles, Plasma Sources Science and Technology, 20(3), 034009.
[9] Song Z., Tang H., Wang N., Zhu L. (2013). Reductive defluorination of perfluorooctanoic acid by hydrated electrons in sulfite-mediated UV photochemical system. Journal of Hazardous Materials, 262, pp. 332-338.
[10] Aleksandrov K., Gehrmann H.J., Hauser M., Mätzing H., Pigeon D., Stapf D., Wexler M. (2019), Waste incineration of Polytetrafluoroethylene (PTFE) to evaluate potential formation of per- and Poly-Fluorinated Alkyl Substances (PFAS) in flue gas, Chemosphere, 226, pp. 898-906.
[11] Horst J., McDonough J., Ross I., Houtz E. (2020), Understanding and Managing the Potential By-Products of PFAS Destruction, Groundwater Monitoring & Remediation.
[12] A. Koch, R. Aro, T. Wang, L. W. Y. Yeung (2020), Towards a comprehensive analytical workflow for the chemical characterisation of organofluorine in consumer products and environmental samples, Trends in Analytical Chemistry.
[13] Method 5050: Bomb preparation method for solid waste, Revision 0, September 1994.
Ringraziamenti
Si ringrazia la Fondazione AMGA (GE) e la Società Acque del Chiampo Spa (VI) per il sostegno finanziario all'attività sperimentale. Un ringraziamento particolare all'Ing. M. Zerlottin e all'Ing. D. Beltrame, per aver supportato lo studio del processo, fornendo materiali ed analisi, e per aver dato una prospettiva industriale all'indagine. Si ringrazia, inoltre, il laboratorio Innovazione Chimica Srl (TV), per l'analisi del fluoro totale.
.jpg)