Gli inceneritori, se adeguatamente equipaggiati, si rivelano degli ottimi alleati sia per lo smaltimento dei rifiuti che per la fornitura di energia. Ma c'è una questione importante da risolvere: le ceneri leggere da combustione
L’innesco incontrollato di polveri metalliche è un fenomeno noto e temuto in molti processi industriali, poiché le polveri vengono utilizzate nelle fasi produttive, ma sono anche un sottoprodotto di svariate lavorazioni. Le polveri metalliche sono caratterizzate da elevata instabilità termo-chimica e durante le operazioni di manipolazione, smaltimento e stoccaggio possono dare origine ad incendi, a causa della loro tendenza ad auto-riscaldarsi, fino ad innescarsi violentemente. Gli scarti di polveri metalliche sono spesso costituiti da leghe o metalli miscelati con i rispettivi ossidi e solo raramente sono costituiti da elementi puri: per questo motivo, predire il loro comportamento o valutarne senza ambiguità l’infiammabilità non è scontato.
Molti metalli e leghe promuovono la reazione di dissociazione dell’acqua (water split reaction [1]), in cui il metallo può reagire con l’acqua, per formare, oltre ad ossidi ed idrossidi, idrogeno gassoso: ciò aggrava il pericolo di esplosione ed infiammabilità connesso all’uso di polveri metalliche. Le polveri metalliche contenenti alluminio sono tra quelle maggiormente reattive: lo studio della reazione di ossidazione dell’Al con acqua, liquida o vapore, è interessante non solo dal punto di vista accademico, ma anche per applicazioni in campo industriale. Per la scienza, questa reazione è un esempio di complesso processo eterogeneo (coinvolgente un reagente liquido, uno solido e un prodotto gassoso), multistadio e fortemente esotermico, in cui il film di ossidazione, che ricopre la superficie del metallo, inibisce l’innesco dei processi di ossidazione del metallo sottostante. I prodotti solidi di nuova formazione controllano a loro volta la successiva ossidazione. La comprensione di questo meccanismo, oltre a calibrare misure preventive di evoluzioni incontrollate, permetterebbe di utilizzare il processo per scopi energetici: si potrebbe auspicare, infatti, l’utilizzo di energia derivante dall’ossidazione profonda dei metalli, considerato che la loro ossidazione con acqua è un processo assolutamente sostenibile [2].
Per contro, gli incendi che possono propagarsi da accumuli di polveri metalliche sono particolarmente difficili da gestire, proprio perché il tradizionale metodo di soppressione delle fiamme con acqua non è compatibile con questo genere di materiali.
Le polveri di alluminio, come altri metalli, in atmosfera umida si ricoprono naturalmente di uno strato di ossido. Nel caso dell’alluminio questo strato è passivante (Passivating Oxide Coating - POC) ed ha lo spessore di pochi nanometri [1]: deriva da una lunga e lenta ossidazione per contatto della superficie delle particelle metalliche con l’umidità presente nell’ambiente. La presenza di questo strato impedisce alle particelle di metallo di subire una successiva ossidazione.
Tuttavia, in presenza di un contributo esterno in grado di rompere questo strato (rottura meccanica in fase di movimentazione del materiale, inneschi elettrostatici, dissoluzione per contatto con agente corrosivo...), il metallo può trovarsi nuovamente esposto e può quindi dare origine a locali surriscaldamenti, con conseguenti inneschi.
Obiettivi
Mediante uno studio scientifico approfondito, si è cercato di migliorare la capacità diagnostica e predittiva del fenomeno di auto-innesco delle polveri metalliche. L’intenzione è quella di comprendere i meccanismi di reazione del processo, rendendo così possibile identificare la migliore tecnologia per rendere le polveri inerti, al fine di ridurre o eliminare il pericolo connesso alla loro manipolazione e stoccaggio, suggerendo modalità di gestione del rifiuto in sicurezza, in vista del conferimento.
Una maggior conoscenza dei processi che avvengono durante la reazione di auto-innesco delle polveri metalliche può essere sfruttata per inertizzare le polveri metalliche stesse, ma anche per valutare la possibilità e l’eventuale vantaggio di recuperare il metallo puro, idrogeno ed energia, che si producono dalla reazione di ossidazione.
Questo intento può essere raggiunto mediante reazioni volte all’ispessimento dello strato di ossido attorno al metallo, condotte generalmente con acqua liquida oppure con ossidanti in fase gas (vapor d’acqua, aria secca o aria umida), in entrambi i casi senza l’utilizzo di attivatori, il cui ruolo sarebbe di disgregare continuamente lo strato di ossido che si forma, consumando via via il metallo sottostante.
Un’altra tecnologia innovativa allo studio, impiegata per raggiungere l’inertizzazione delle polveri metalliche, è il trattamento che prevede l’utilizzo di sostanze chelanti, ovvero composti in grado di legarsi chimicamente alle polveri metalliche, inibendo in questo modo una loro successiva reazione di ossidazione ([3], [4], [5]).
Sperimentazioni e risultati
In questa sezione vengono descritti e discussi i test di inertizzazione delle polveri metalliche, condotti mediante l’utilizzo di acqua liquida.
Gli studi condotti in letteratura scientifica riguardanti l’inertizzazione di polveri d’alluminio, mediante trattamenti in acqua ([6], [7]), non indagano le condizioni sperimentali ottimali di impiego, né l’efficacia dei trattamenti su altre tipologie di polveri.
In questo studio, è stata perciò eseguita una campagna sperimentale sistematica con lo scopo di investigare l’effetto di parametri chiave nei trattamenti di inertizzazione, quali la temperatura di reazione ed il tempo di trattamento, eseguendo i test su due diversi campioni di polvere metallica, a base alluminio e ferro.
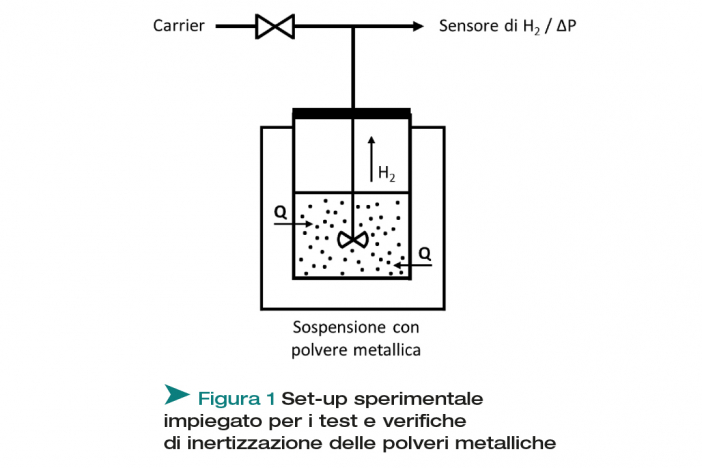
L’apparato sperimentale realizzato è rappresentato schematicamente in Figura 1.
Esso prevede l’utilizzo di un reattore semi-batch, miscelato ed esternamente riscaldato, in cui vengono fatte reagire la polvere metallica (Al o Fe) e l’acqua (pura o addizionata con agenti corrosivi dello strato di ossido). Con questo apparato è possibile monitorare la produzione di H2, avere il controllo sulla temperatura di reazione e sul tempo di trattamento della polvere, parametri variati nei seguenti range operativi:
• temperatura: da Tambiente fino a 100°C
• tempi di trattamento: da 1h a oltre 17h di test
È importante sottolineare che l’idrogeno è l’unico gas prodotto dalla reazione di un metallo con l’acqua ed è quindi indice non solo della reattività istantanea della polvere metallica, ma anche del suo grado di inertizzazione, ossia della sua reattività residua.
Effetto della temperatura sul trattamento di inertizzazione
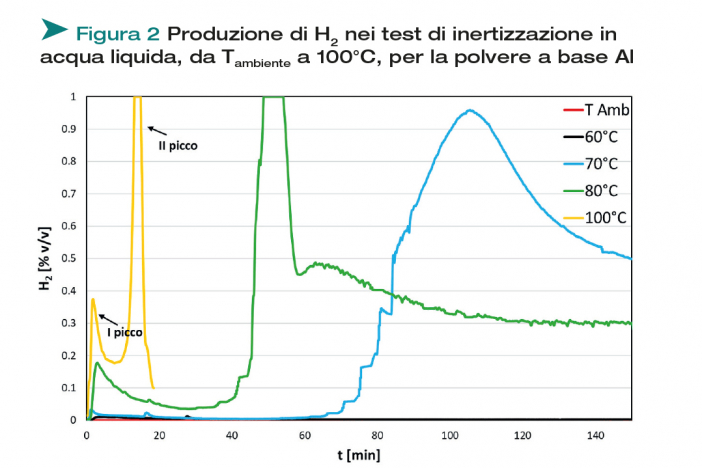
Con il setup di Figura 1 sono stati eseguiti i test di inertizzazione in acqua delle polveri a base Al e Fe, a diverse temperature di reazione, monitorando l’idrogeno prodotto dalla reazione con l’acqua. La concentrazione di idrogeno prodotta viene misurata mediante un sensore elettrochimico. I risultati delle misure riportate nelle figure sono espressi in tensione del segnale misurato. Le concentrazioni volumetriche di H2 ottenute dalla polvere di alluminio, operando a diverse temperature, sono riportate in Figura 2.
A temperature inferiori ai 70°C, la produzione di idrogeno non è apprezzabile, nei tempi di durata dei test (ore). A partire dai 70°C, invece, la polvere a base di Al mostra una significativa produzione di H2, che si sviluppa in due momenti distinti: all’inizio, compare una debole produzione di idrogeno (I picco), dovuta ad una prima ossidazione della polvere metallica, con la creazione di uno strato di ossido passivante sulla superficie del metallo, che inibisce rapidamente il progredire dell’ossidazione. Tra il primo ed il secondo picco di produzione di idrogeno, questo strato di ossido subisce un processo di idrolisi-rideposizione, che comporta la formazione di uno strato di ossido permeabile, che permette nuovamente il contatto diretto tra acqua e metallo ([7], [8]). Di conseguenza, si re-innesca la reazione di ossidazione del metallo presente all’interno della particella, dando luogo al secondo picco di produzione di idrogeno, decisamente più intenso del primo, così come osservato in [2]. Il processo risulta fortemente influenzato dalla temperatura: all’aumentare della T, infatti, la produzione di idrogeno si fa più intensa e via via anticipata nel tempo, fino a quando il primo ed il secondo picco tendono a sovrapporsi.
La polvere a base ferro (risultati non presentati) non crea uno strato di ossido passivante come l’alluminio, per cui non si ha la formazione del doppio picco di produzione di idrogeno: il ferro, a differenza dell’alluminio, mostra una produzione di idrogeno unica, più intensa nella fase iniziale del test, che va poi lentamente smorzandosi. Come per le polveri a base alluminio, l’effetto di un aumento di temperatura, comporta un innesco più precoce e di conseguenza un esaurimento più rapido del fenomeno.
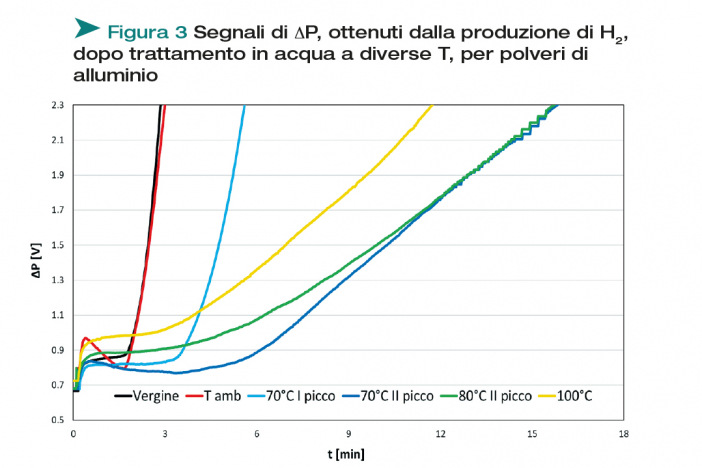
Al fine di valutare l’efficacia del trattamento di inertizzazione eseguito, la polvere trattata in acqua viene messa a contatto con una soluzione acquosa contenente una base forte, in grado di dissolvere lo strato protettivo di ossido, creato attorno alla particella metallica durante il trattamento. Anche nel corso di questo test, viene monitorato in continuo l’idrogeno prodotto. Diversamente da prima, però, viene utilizzato un contenitore completamente chiuso (Figura 1, con valvola OFF) e la produzione di idrogeno viene monitorata attraverso l’aumento di pressione. I profili di rilascio vengono confrontati con quello relativo alla polvere non trattata (vergine), deducendone qualitativamente il grado di inertizzazione raggiunto. I risultati di queste verifiche sono riportati in Figura 3.
Verifica del grado di inertizzazione
L’efficacia di inertizzazione viene determinata considerando due parametri chiave: il tempo di induzione, cioè il momento in cui la polvere inizia a reagire con l’ossidante (acqua), per generare idrogeno, e la pendenza della curva, indice della velocità della reazione di ossidazione. Per quanto riguarda la polvere a base alluminio, si può notare che il trattamento in acqua a temperatura ambiente non cambia la reattività della polvere iniziale, ovvero non vi è alcuna inertizzazione.
Le polveri trattate a 70°C sono state divise in due campioni: un primo campione è stato pretrattato solo fino al termine del primo picco presente nella Figura 2 (fino a circa 40 min di test) e quindi estratto dall’acqua. Il secondo campione, invece, ha subito il trattamento completo, riflesso dal secondo picco che corrisponde all’ulteriore ossidazione del metallo. La verifica della reattività di questi due campioni è molto istruttiva: il trattamento a 70°C interrotto dopo il primo picco, mostra una minima inertizzazione (ritardo nel tempo di induzione), ma ha una reattività (pendenza della curva) comparabile alla polvere non trattata. Invece, tutti i trattamenti condotti fino al raggiungimento del secondo picco, compreso quello a 70°C, presentano tempi di induzione e velocità di reazione decisamente diversi, rispetto alla polvere non trattata: in particolare, la produzione di idrogeno procede decisamente più lenta. Questo comportamento è indice del fatto che si è formato uno strato di ossido più spesso, tale da rendere la diffusione dell’acqua all’interno dello strato più difficoltosa.
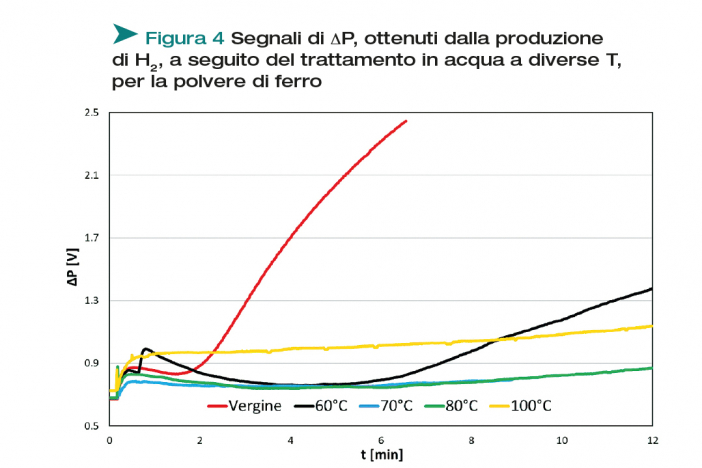
La polvere a matrice ferrosa dopo il trattamento mostra una reattività nettamente inferiore rispetto alla polvere non trattata (Figura 4), per qualsiasi temperatura. Resta una blanda reattività residua con il trattamento in acqua alla minima temperatura (60°C), che scompare a temperature superiori.
Effetto del tempo di trattamento di inertizzazione
Per valutare l’effetto del tempo di trattamento sull’inertizzazione delle polveri, sono stati condotti test a tempi di trattamento diversi, fissando la temperatura. Sia per la polvere di Al che per quella di Fe, la temperatura di riferimento è fissata a 80°C.
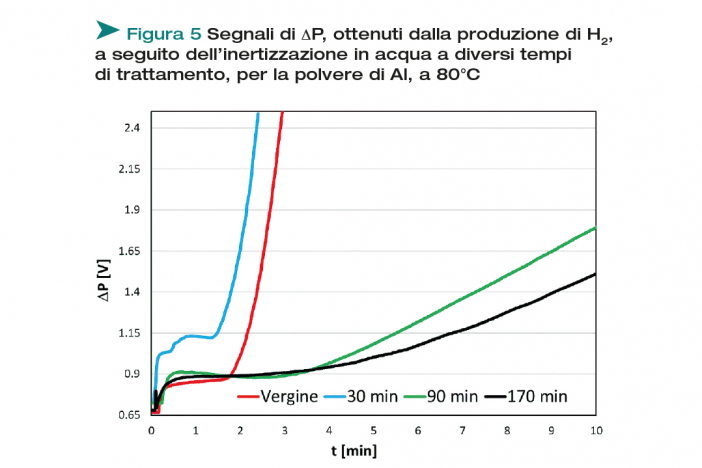
Per l’alluminio, i test sono stati condotti ad un tempo di trattamento pari a 30, 90 e 170 min. I risultati sperimentali della verifica del grado di inertizzazione sono riportati in Figura 5.
Dopo il trattamento a 30 min, corrispondente allo sviluppo del solo I picco (Figura 2), la reattività della polvere di Al è la medesima della polvere non trattata, segno che, ad 80°C, questo tempo di trattamento non è sufficiente ad inertizzare la polvere. Laddove il II picco ha il tempo per svilupparsi (90 e 170 min di trattamento), la reattività della polvere risulta notevolmente diminuita. Questi ultimi due trattamenti non sono significativamente diversi: se ne conclude che dopo un’ora e mezza il trattamento ha già raggiunto una situazione asintotica.
Le stesse combinazioni di temperatura (80°C) e tempi di trattamento (30-90-170 min) sono stati sperimentati sulla polvere a matrice ferrosa (risultati non presentati): il trattamento a 30 min non è risultato sufficiente ad inertizzare completamente la polvere, mentre i trattamenti a 90 min e a 170 min generano profili di reattività pressoché identici e piatti (cioè nessuna reattività). Si può quindi affermare che, anche in questo caso, già il trattamento a 90 min è sufficiente ad inertizzare la polvere.
L’inertizzazione delle polveri metalliche in acqua liquida risulta efficace per entrambe le tipologie di polvere testate ed è ottimale alle condizioni sperimentali di 80°C e 90 min di tempo di trattamento: la combinazione di questi due parametri garantisce la comparsa del secondo picco di produzione di idrogeno per la polvere a base alluminio, che è indice della completa inertizzazione della polvere, in un tempo sufficientemente rapido. Anche per la polvere a base ferro, queste condizioni sperimentali assicurano una sua completa inertizzazione.
Conclusioni
Le polveri metalliche hanno la tendenza ad auto-riscaldarsi, fino ad innescarsi violentemente, con il conseguente rischio di sviluppare incendi. Lo studio presentato intende contribuire all’identificazione di una tecnologia sostenibile per inertizzare le polveri metalliche, al fine di ridurre o eliminare il pericolo connesso alla loro manipolazione e conservazione.
In questo studio, si sono approfonditi i meccanismi di innesco e di inertizzazione di due diverse tipologie di polvere metallica, a base alluminio e a base ferro, con l’obiettivo di stabilizzarle.
La sperimentazione ha consentito di individuare, come miglior processo di inertizzazione, il trattamento delle polveri metalliche in acqua liquida: l’acqua funge da agente ossidante, creando uno strato d’ossido protettivo attorno alle particelle, in grado di prevenire successive reazioni. Le condizioni sperimentali ottimali, identificate nel corso della campagna sperimentale, corrispondono ad una temperatura di reazione di 80°C e ad un tempo di trattamento di 90 min, per entrambe le tipologie di polvere.
Questo tipo di trattamento è relativamente semplice da gestire ed economico, ragionevolmente anche su scala industriale.
Da rilevare che il processo di inertizzazione produce idrogeno e calore, che potrebbero essere valorizzati. Inoltre, un’adeguata inertizzazione potrebbe agevolare il trasporto e lo stoccaggio, facilitando successivi processi di recupero del metallo. Questi aspetti hanno importanza in un’ottica di economia circolare, per un uso responsabile ed integrato delle risorse naturali, minimizzando gli scarti e recuperando energia.
Ringraziamenti
Si ringrazia la Regione Veneto per il supporto finanziario, erogato attraverso il Bando POR FESR 2014-2020, DGR N. 805 del 11/06/2019. Un ringraziamento particolare all’Ing. Giuseppe Carraro di Centro Risorse Srl e al Dott. Edoardo Agusson di Innovazione Chimica Srl, per aver sostenuto lo studio del processo, fornito materiali ed analisi, e dato una prospettiva industriale all’indagine.
Bibliografia
[1] Nie H., Schoenitz M., Dreizin E. L., Calorimetric investigation of the aluminum-water reaction, International Journal of Hydrogen Energy, 37 (2012) pp. 11035-11045.
[2] Nikolaevich L. M., Reaction of Al powders with liquid water and steam. Metal nanopowders: production, characterization and energetic applications, First Edition by Wiley, (2014).
[3] Zheng X., Xu K., Wang Y., Wang Q, Hydrogen inhibition method for preventing hydrogen explosion accident in west dust removal system, Internation Journal of Hydrogen Energy, 44 (2019) pp. 17195-17201.
[4] Zheng X., Xu K., Wang Q., Shen R., Wang Y., Hydrogen inhibition in wet dust removal systems by using calcium lignosulfunate (CLS), Internation Journal of Hydrogen Energy, 44 (2019) pp. 25091-25100.
[5] Wang B., Kaili X., Wang Y., Using sodium D-gluconate to suppress hydrogen production in wet aluminium waste dust collection system, Journal of Hazardous Materials 397 (2020) pp. 122780.
[6] Petrovic K., Thomas G., Reaction of Aluminum with Water to Produce Hydrogen - 2010 Update, United States, (2011).
[7] Nie H., Zhang S., Schoenitz M., Dreizin E., Reaction interface between aluminum and water, Internation Journal of Hydrogen Energy, 38:26 (2013) pp. 11222-11232.
[8] Trunov M. A., Schoenitz M., Dreizin E. L., Effect of polymorphic phase transformations in alumina layer on ignition of aluminium particles, Combustion theory and modelling, 10:4 (2006) pp. 603-623.
.jpg)